wybierz konsultacje
Którą konsultacje wybrać?
Wybierze E-recepte Express, jeśli bierzesz lek na stałe i masz poprzednią receptę
Wybierz E-konsultację, jeśli chcesz rozpocząć terapię danym lekiem
Jak to działa?
Wybierz lek
Jeśli występujesz o lek psychotropowy lub silny lek przeciwbólowy, prosimy Cię o udostępnienie IKP oraz zaświadczenia od lekarza prowadzącego.
Wypełnij formularz medyczny
Poczekaj na telefon
Jeśli jesteś nowym pacjentem Dimedic i pierwszy raz wnioskujesz o ten lek, lekarz zadzwoni by przeprowadzić badanie.
Odbierz dokumentację
Po pozytywnej decyzji lekarza odbierz receptę SMSem lub emailem.
Więcej o leku: Evra
Skład:
1 system transdermalny (plaster) zawiera 6 mg norelgestrominu i 600 µg etynyloestradiolu (1 system uwalnia 203 µg norelgestrominu i 33,9 µg etynyloestradiolu w ciągu 24 h).
Warianty leku
| Nazwa | Postać leku | Dawka | Opakowanie |
|---|---|---|---|
| Evra | system transdermalny, plaster | (203 µg+33,9 µg)/24 h | 3 szt. |
EVRA, (203 mikrogramy + 33,9 mikrogramów)/24 godziny, system transdermalny, plaster
Ważne informacje dotyczące złożonych środków antykoncepcyjnych
- Jeśli są stosowane prawidłowo, stanowią jedną z najbardziej niezawodnych, odwracalnych metod antykoncepcji
- W nieznacznym stopniu zwiększają ryzyko powstania zakrzepów krwi w żyłach i tętnicach, zwłaszcza w pierwszym roku stosowania lub po wznowieniu stosowania po przerwie równej 4 tygodnie lub więcej
- Należy zachować czujność i skonsultować się z lekarzem, jeśli pacjentka podejrzewa, że wystąpiły objawy powstania zakrzepów krwi (patrz punkt 2 „Zakrzepy krwi”)
- Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- Należy zwrócić się do lekarza, farmaceuty lub pielęgniarki, w razie jakichkolwiek wątpliwości.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie.
- Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce.
Patrz punkt 4.
1. Co to jest lek EVRA i w jakim celu się go stosuje
Lek EVRA zawiera dwa rodzaje hormonów, progestagen o nazwie norelgestromin i estrogen o nazwie etynyloestradiol.
Lek EVRA nazywany jest „złożonym, hormonalnym lekiem antykoncepcyjnym”, ponieważ w jego skład wchodzą dwa hormony.
Antykoncepcja hormonalna jest stosowana w zapobieganiu ciąży.
2. Informacje ważne przed zastosowaniem leku
Uwagi ogólne
Przed rozpoczęciem przyjmowania leku należy zapoznać się z informacjami dotyczącymi zakrzepów krwi w punkcie 2. Jest szczególnie ważne, aby zapoznać się z objawami wystąpienia zakrzepów krwi (patrz punkt 2 „Zakrzepy krwi”).
Kiedy nie stosować leku
Nie należy stosować leku jeśli u pacjentki występuje jakikolwiek z wymienionych poniżej stanów. Jeśli u pacjentki występuje jakikolwiek z wymienionych poniżej stanów, należy poinformować o tym lekarza. Lekarz omówi z pacjentką, jaki inny środek zapobiegania ciąży będzie bardziej odpowiedni.
- jeśli u pacjentki obecnie występuje (lub kiedykolwiek występował) zakrzep krwi w naczyniach żylnych nóg (zakrzepica żył głębokich), w płucach (zatorowość płucna) lub w innych organach;
- jeśli pacjentka wie o zaburzeniach wpływających na krzepliwość krwi - na przykład niedobór białka C, niedobór białka S, niedobór antytrombiny III, obecność czynnika V Leiden lub przeciwciał antyfosfolipidowych;
- jeśli pacjentka wymaga zabiegu chirurgicznego lub nie będzie chodziła przez długi okres czasu (patrz punkt „Zakrzepy krwi”).
- jeśli pacjentka przeszła zawał serca lub udar;
- jeśli pacjentka choruje (lub chorowała w przeszłości) na dusznicę bolesną (choroba, która powoduje silny ból w klatce piersiowej i może być pierwszym objawem zawału serca) lub przemijający napad niedokrwienny (przemijające objawy udaru);
- jeśli pacjentka choruje na jakąkolwiek z poniższych chorób, które mogą zwiększać ryzyko powstania zakrzepu w tętnicy:
+ ciężka cukrzyca z przebiegającym uszkodzeniem naczyń krwionośnych
+ bardzo wysokie ciśnienie krwi;
+ bardzo wysokie stężenie tłuszczu we krwi (cholesterolu lub trójglicerydów).
+ chorobę nazywaną hiperhomocysteinemią
- jeśli u pacjentki występuje (lub występowała w przeszłości) rodzaj migreny nazywany „migreną z aurą”;
- jeśli pacjentka ma uczulenie na norelgestromin, etynyloestradiol lub którykolwiek z pozostałych składników tego leku (wymienione w punkcie 6).
- jeśli u pacjentki wystąpiły kiedykolwiek nowotwory piersi, trzonu macicy, szyjki macicy lub pochwy.
- jeśli u pacjentki wystąpiły kiedykolwiek nowotwory wątroby lub jakiekolwiek schorzenia wątroby z powodu których nie działa ona prawidłowo.
- jeśli u pacjentki występują niewyjaśnione krwawienia z pochwy.
Nie należy stosować leku w przypadku występowania którejkolwiek z powyższych chorób.
W razie wątpliwości przed zastosowaniem leku należy skonsultować się z lekarzem, farmaceutą lub pielęgniarką.
Kiedy zachować szczególną ostrożność stosując lek
Kiedy należy skontaktować się z lekarzem?
Należy natychmiast zgłosić się do lekarza
- jeśli pacjentka zauważy prawdopodobne objawy wystąpienia zakrzepów krwi, co może wskazywać na to, że pacjentka ma zakrzepy krwi w nodze (zakrzepica żył głębokich), zakrzepy krwi w płucach (zator tętnicy płucnej), zawał serca lub udar (patrz punkt poniżej „Zakrzepy krwi (zakrzepica)”).
W celu uzyskania opisu objawów wymienionych poważnych działań niepożądanych, patrz „Jak rozpoznać powstanie zakrzepów krwi”.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania tego leku należy zgłosić się do lekarza w celu przeprowadzenia badań.
Należy powiedzieć lekarzowi, jeśli u pacjentki występuje jakikolwiek z następujących stanów.
Jeśli objawy te pojawią się lub pogorszą w czasie stosowania leku, również należy powiedzieć o tym lekarzowi.
- jeśli pacjentka ma chorobę Crohna lub wrzodziejące zapalenie jelita grubego (przewlekłe zapalne choroby jelit);
- jeśli pacjentka ma toczeń rumieniowaty układowy (choroba wpływająca na naturalny system obronny);
- jeśli pacjentka ma zespół hemolityczno-mocznicowy (zaburzenie krzepnięcia krwi powodujące niewydolność nerek);
- jeśli pacjentka ma niedokrwistość sierpowatą (dziedziczna choroba czerwonych krwinek);
- jeśli u pacjentki stwierdzono podwyższony poziom tłuszczu we krwi (hipertrigliceridemia) lub dodatni wywiad rodzinny dla tej choroby. Hipertrigliceridemia jest związana ze zwiększonym ryzykiem rozwoju zapalenia trzustki;
- jeśli pacjentka wymaga zabiegu chirurgicznego lub nie będzie chodziła przez długi okres czasu (patrz punkt 2 „Zakrzepy krwi”.)
- jeśli pacjentka jest bezpośrednio po porodzie, wówczas jest ona w grupie podwyższonego ryzyka powstania zakrzepów krwi. Należy zwrócić się do lekarza w celu uzyskania informacji, jak szybko można rozpocząć przyjmowanie leku po porodzie.
- Jeśli pacjentka ma zapalenie żył pod skórą (zakrzepowe zapalenie żył powierzchniowych).
- Jeśli pacjentka ma żylaki.
ZAKRZEPY KRWI
Stosowanie złożonych hormonalnych środków antykoncepcyjnych, takich jak lek jest związane ze zwiększeniem ryzyka powstania zakrzepów krwi, w porównaniu do sytuacji gdy terapia nie jest stosowana. W rzadkich przypadkach zakrzep krwi może zablokować naczynie krwionośne i spowodować ciężkie zaburzenia.
Zakrzepy krwi mogą powstać
- w żyłach (nazywane dalej „zakrzepica żylna” lub „żylna choroba zakrzepowo-zatorowa”)
- w tętnicach (nazywane dalej „zakrzepica tętnic” lub „zaburzenia zakrzepowo-zatorowe tętnic”).
Nie zawsze następuje całkowity powrót do zdrowia po przebytym zakrzepie krwi. W rzadkich przypadkach skutki zakrzepu krwi mogą być trwałe lub, bardzo rzadko, śmiertelne.
Należy pamiętać, że całkowite ryzyko wystąpienia szkodliwych zakrzepów krwi wywołanych stosowaniem leku jest niewielkie.
JAK ROZPOZNAĆ WYSTĄPIENIE ZAKRZEPÓW KRWI
Należy natychmiast zgłosić się do lekarza, jeśli zauważy się jakikolwiek z poniższych objawów.
Czy pacjentka doświadcza któregoś z tych objawów? | Z jakiego powodu prawdopodobnie cierpi pacjentka? |
• obrzęk nogi lub obrzęk wzdłuż żyły w nodze lub na stopie, szczególnie, gdy towarzyszy temu: • ból lub tkliwość w nodze, które mogą być odczuwane wyłącznie w czasie stania lub chodzenia; • zwiększona temperatura w zmienionej chorobowo nodze; • zmiana koloru skóry nogi, np. zblednięcie, zaczerwienienie, zasinienie. | Zakrzepica żył głębokich |
• nagły napad niewyjaśnionych duszności lub przyspieszenia oddechu; • nagły napad kaszlu bez oczywistej przyczyny, który może być połączony z pluciem krwią; • ostry ból w klatce piersiowej, który może nasilać się przy głębokim oddychaniu; • ciężkie zamroczenie lub zawroty głowy; • przyspieszone lub nieregularne bicie serca; • silny ból w żołądku. Jeśli pacjentka nie jest pewna, należy zgłosić się do lekarza, ponieważ niektóre z tych objawów, takie jak kaszel lub spłycenie oddechu mogą zostać pomylone z łagodniejszymi stanami, takimi jak zakażenie układu oddechowego (np. przeziębienie). | Zator tętnicy płucnej |
Objawy występują najczęściej w jednym oku: • natychmiastowa utrata widzenia lub • bezbolesne zaburzenia widzenia, które mogą przekształcić się w utratę widzenia. | Zakrzepica żył siatkówki (zakrzep krwi w oku) |
• ból w klatce piersiowej, uczucie dyskomfortu, uczucie nacisku, ociężałość; • uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka; • uczucie pełności, niestrawności lub zadławienia; • uczucie dyskomfortu w dolnej części ciała promieniujące do pleców, szczęki, gardła, ramienia i żołądka; • pocenie się, nudności, wymioty lub zawroty głowy; • skrajne osłabienie, niepokój lub spłycenie oddechu; • przyspieszone lub nieregularne bicie serca. | Zawał serca |
• nagłe osłabienie lub zdrętwienie twarzy, rąk lub nóg, szczególnie po jednej stronie ciała; • nagłe splątanie, zaburzenia mówienia lub rozumienia; | Udar |
ZAKRZEPY KRWI W ŻYLE
Co może się zdarzyć, jeśli w żyle powstaną zakrzepy krwi?
- Stosowanie złożonych hormonalnych środków antykoncepcyjnych jest związane ze zwiększonym ryzykiem wystąpienia zakrzepów krwi w żyłach (zakrzepica żylna). Choć te działania niepożądane występują rzadko. Najczęściej występują one w pierwszym roku stosowania złożonych hormonalnych środków antykoncepcyjnych.
- Jeśli zakrzepy krwi formują się w żyłach znajdujących się w nodze lub w stopie, może to prowadzić do rozwinięcia się zakrzepicy żył głębokich.
- Jeśli zakrzep krwi przemieści się z nogi i umiejscowi w płucach, może to spowodować zator tętnicy płucnej.
- W bardzo rzadkich przypadkach zakrzep może utworzyć się w innym organie, takim jak oko (zakrzepica żył siatkówki).
Kiedy istnieje najwyższe ryzyko powstania zakrzepów krwi w żyle?
Ryzyko utworzenia się zakrzepów krwi w żyle jest największe w czasie pierwszego roku stosowania złożonych hormonalnych środków antykoncepcyjnych po raz pierwszy. Ryzyko może być również większe w przypadku wznowienia stosowania złożonych hormonalnych środków antykoncepcyjnych (tego samego lub innego leku) po przerwie równej 4 tygodnie lub więcej.
Po pierwszym roku, ryzyko zmniejsza się, jakkolwiek zawsze jest większe w porównaniu do sytuacji, gdy nie stosuje się złożonych hormonalnych środków antykoncepcyjnych.
Jeśli pacjentka przestanie stosować lek ryzyko powstawania zakrzepów krwi wraca do normalnego poziomu w ciągu kilku tygodni.
Od czego zależy ryzyko powstania zakrzepów krwi?
Ryzyko zależy od naturalnego ryzyka wystąpienia żylnej choroby zakrzepowo-zatorowej i rodzaju stosowanego złożonego hormonalnego środka antykoncepcyjnego.
Całkowite ryzyko powstania zakrzepów krwi w nogach lub płucach związane ze stosowaniem leku EVRA jest niewielkie.
- W okresie roku, u około 2 na 10 000 kobiet, które nie stosują złożonych hormonalnych środków antykoncepcyjnych i nie są w ciąży, powstaną zakrzepy krwi.
- W okresie roku, u około 5-7 na 10 000 kobiet, które stosują złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel, noretisteron lub norgestimat powstaną zakrzepy krwi.
- W okresie roku, u około 6 do 12 na 10 000 kobiet, które stosują złożone hormonalne środki antykoncepcyjne zawierające etonorgestrel lub norelgestromin, np. lek EVRA powstaną zakrzepy krwi.
- Ryzyko powstania zakrzepów krwi zależy od indywidualnej historii medycznej pacjentki (patrz „Czynniki, które zwiększają ryzyko powstania zakrzepów krwi”, poniżej)
Ryzyko powstania zakrzepów krwi w ciągu roku | |
Kobiety, które nie stosują złożonych hormonalnych tabletek, plastrów, systemów dopochwowych i nie są w ciąży | Około 2 na 10 000 kobiet |
Kobiety stosujące złożone hormonalne tabletki antykoncepcyjne zawierające lewonorgestrel, noretisteron lub norgestimat | Około 5-7 na 10 000 kobiet |
Kobiety stosujące lek Naraya | Około 9-12 na 10 000 kobiet |
Czynniki zwiększające ryzyko powstania zakrzepów krwi w żyłach
Ryzyko powstania zakrzepów krwi związane ze stosowaniem leku jest niewielkie, jednak niektóre czynniki mogą zwiększyć to ryzyko. Ryzyko jest większe:
- jeśli pacjentka ma dużą nadwagę (wskaźnik masy ciała (BMI) powyżej 30 kg/m2);
- jeśli u kogoś z najbliższej rodziny pacjentki stwierdzono obecność zakrzepów krwi w nogach, płucach lub innych organach w młodym wieku (np. w wieku poniżej 50 lat). W tym przypadku pacjentka może mieć dziedziczne zaburzenia krzepnięcia;
- jeśli pacjentka musi poddać się operacji, jeśli jest unieruchomiona przez dłuższy czas z powodu kontuzji bądź choroby lub ma nogę w gipsie. Może być konieczne przerwanie stosowania leku EVRA na kilka tygodni przed operacją lub ograniczeniem ruchomości. Jeśli pacjentka musi przerwać stosowanie leku, należy zapytać lekarza, kiedy można wznowić stosowanie leku.
- wraz z wiekiem (szczególnie powyżej 35 roku życia);
- jeśli pacjentka urodziła dziecko w okresie ostatnich kilku tygodni
Ryzyko powstania zakrzepów krwi zwiększa się wraz z liczbą czynników ryzyka obecnych u pacjentki.
Podróż samolotem (>4 godzin) może tymczasowo zwiększać ryzyko powstania zakrzepów krwi, szczególnie jeśli u pacjentki występuje inny wymieniony czynnik ryzyka.
Ważne jest, aby powiedzieć lekarzowi, jeśli któryś z wymienionych czynników występuje u pacjentki, nawet jeśli nie jest się pewnym. Lekarz może zadecydować o zaprzestaniu stosowania leku.
Jeśli jakikolwiek z powyższych stanów ulegnie zmianie w czasie stosowania leku, np. u kogoś z najbliższej rodziny zostanie stwierdzona zakrzepica bez znanej przyczyny lub jeśli pacjentka znacznie przytyje, należy powiedzieć o tym lekarzowi.
ZAKRZEPY KRWI W TĘTNICY
Co może się zdarzyć, jeśli w tętnicy powstaną zakrzepy krwi?
Podobnie jak w przypadku zakrzepów krwi w żyłach, zakrzepy w tętnicy mogą spowodować poważne konsekwencje, na przykład zawał serca lub udar.
Czynniki zwiększające ryzyko powstania zakrzepów krwi w tętnicach
Ważne jest, aby podkreślić, że ryzyko zawału serca lub udaru związane ze stosowaniem leku jest bardzo małe, ale może wzrosnąć:
- z wiekiem (powyżej około 35 lat),
- jeśli pacjentka pali papierosy. Podczas stosowania hormonalnego środka antykoncepcyjnego takiego jak, zaleca się zaprzestanie palenia. Jeśli pacjentka nie jest w stanie przerwać palenia i jest w wieku powyżej 35 lat, lekarz może zalecić stosowanie innego rodzaju antykoncepcji,
- jeśli pacjentka ma nadwagę,
- jeśli pacjentka ma wysokie ciśnienie tętnicze,
- jeśli u kogoś z najbliższej rodziny stwierdzono zawał serca lub udar w młodym wieku (poniżej 50 roku życia). W tym przypadku pacjentka może również być w grupie podwyższonego ryzyka wystąpienia zawału serca lub udaru,
- jeśli u pacjentki lub kogoś z jej najbliższej rodziny stwierdzono wysoki poziom tłuszczu we krwi (cholesterolu lub trójglicerydów),
- jeśli pacjentka ma migreny, a szczególnie migreny z aurą,
- jeśli pacjentka ma chore serce (uszkodzenie zastawki, zaburzenia rytmu serca nazywane migotaniem przedsionków),
- jeśli pacjentka ma cukrzycę.
Jeśli u pacjentki występuje więcej niż jeden z powyższych stanów lub jeżeli jakikolwiek z nich jest szczególnie ciężki, ryzyko powstania zakrzepów krwi może być jeszcze bardziej zwiększone.
Jeśli jakikolwiek z powyższych stanów ulegnie zmianie w czasie stosowania leku, np. pacjentka zacznie palić, u kogoś z najbliższej rodziny zostanie stwierdzona zakrzepica bez znanej przyczyny lub jeśli pacjentka znacznie przytyje, należy powiedzieć o tym lekarzowi.
Ponadto w przypadku wystąpienia lub pogorszenia się jakiegokolwiek spośród następujących stanów podczas stosowania leku należy skonsultować się z lekarzem, farmaceutą lub pielęgniarką:
- podejrzenie ciąży,
- nasilające się lub występujące częściej bóle głowy,
- masa ciała 90 kg lub większa,
- wysokie ciśnienie tętnicze lub wzrastanie ciśnienia,
- choroba pęcherzyka żółciowego w tym kamica lub zapalenie pęcherzyka żółciowego,
- choroba krwi zwana porfirią,
- choroba układu nerwowego wywołująca nagłe ruchy ciała zwana „pląsawicą Sydenhama”,
- wysypka skórna z pęcherzykami w czasie ciąży (zwana „opryszczką ciężarnych”),
- utrata słuchu,
- cukrzyca,
- depresja,
- padaczka lub inne schorzenie mogące wywołać drgawki,
- zaburzenia czynności wątroby powodujące zażółcenie skóry i twardówek oczu (żółtaczka),
- „plamy ciążowe”, czyli żółtawo-brązowe plamy lub punkciki, szczególnie na twarzy (zwane „ostudą”). Plamy te mogą nie ustąpić nawet po zakończeniu stosowania leku.
Należy chronić skórę przed światłem słonecznym i promieniowaniem ultrafioletowym.
To pomoże zapobiec wystąpieniu plam lub ich nasileniu,
- choroby nerek.
W przypadku wątpliwości co do występowania powyższych stanów należy skonsultować się z lekarzem lub farmaceutą przed rozpoczęciem stosowania leku.
Choroby przenoszone drogą płciową
Lek nie chroni przed zakażeniem HIV (AIDS) ani żadnymi innymi chorobami przenoszonymi drogą płciową (np. chlamydiami, opryszczką narządów płciowych, brodawkami narządów płciowych, rzeżączką, wirusowym zapaleniem wątroby typu B oraz kiłą). W celu zabezpieczenia się przed tymi chorobami konieczne jest stosowanie prezerwatywy.
Badania laboratoryjne
- W razie potrzeby wykonywania jakichkolwiek badań laboratoryjnych krwi lub moczu należy poinformować lekarza lub personel medyczny pobierający próbkę o stosowaniu leku EVRA, ponieważ może on wpływać na wyniki niektórych testów.
Dzieci i młodzież
Nie badano leku u dzieci i młodzieży w wieku poniżej 18 lat. Leku nie wolno stosować u dzieci i młodzieży przed rozpoczęciem miesiączkowania.
Inne leki i EVRA
Należy powiedzieć lekarzowi o wszystkich lekach przyjmowanych obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować.
Niektóre leki i preparaty ziołowe mogą spowodować nieskuteczność leku EVRA, co oznacza, że kobieta może zajść w ciążę lub może wystąpić nieoczekiwane krwawienie.
Dotyczy to m.in. leków stosowanych w leczeniu:
- niektóre leki stosowane w leczeniu HIV/AIDS oraz wirusowego zapalenia wątroby typu C (tak zwane inhibitory proteazy i nie-nukleozydowe inhibitory odwrotnej transkryptazy takie jak rytonawir, newirapina, efawirenz),
- leki stosowane w leczeniu zakażeń (takie jak ryfampicyna i gryzeofulwina),
- leki przeciwpadaczkowe (takie jak barbiturany, topiramat, fenytoina, karbamazepina, prymidon, oksykarbazepina i felbamat),
- bozentan (lek stosowany w nadciśnieniu tętniczym naczyń płuc),
- preparaty z dziurawca – (środki ziołowe stosowane w leczeniu depresji).
Podczas przyjmowania jakiegokolwiek z wyżej wymienionych leków należy rozważyć stosowanie innej metody antykoncepcji (takiej jak prezerwatywa, krążek maciczny czy pianka). W przypadku niektórych z wyżej wymienionych leków działanie zakłócające antykoncepcję może trwać do 28 dni po zaprzestaniu ich przyjmowania. Należy porozmawiać z lekarzem lub farmaceutą o zastosowaniu innej metody antykoncepcji w razie jednoczesnego stosowania leku i któregokolwiek z wyżej wymienionych.
EVRA może również powodować, że niektóre leki będą mniej skuteczne. Zalicza się do nich:
- leki zawierające cyklosporynę,
- lamotryginę stosowaną w padaczce (może to spowodować zwiększenie ryzyka napadu padaczkowego).
Lekarz może zmienić dawki tych leków. Przed zastosowaniem jakiegokolwiek leku należy skonsultować się z lekarzem lub farmaceutą.
Ciąża i karmienie piersią
- Nie należy stosować tego leku w czasie ciąży lub gdy istnieje podejrzenie zajścia w ciążę.
- Po zajściu w ciążę należy niezwłocznie przerwać stosowanie tego leku.
- Nie należy stosować tego leku w czasie karmienia piersią lub planowania karmienia.
W ciąży i w okresie karmienia piersią lub gdy istnieje podejrzenie, że kobieta jest w ciąży, lub gdy planuje ciążę, przed zastosowaniem tego leku należy poradzić się lekarza lub farmaceuty.
Prowadzenie pojazdów i obsługiwanie maszyn
Podczas stosowania tego leku można prowadzić pojazdy i obsługiwać maszyny.
Ryzyko związane ze stosowaniem złożonych hormonalnych leków antykoncepcyjnych.
Następująca informacja oparta jest na danych uzyskanych w wyniku stosowania doustnych leków antykoncepcyjnych. Ponieważ lek w postaci systemu transdermalnego, plastra zawiera hormony podobne do hormonów zawartych w doustnych lekach antykoncepcyjnych, ich stosowanie wiąże się z tym samym ryzykiem. Wszystkie złożone hormonalne środki antykoncepcyjne stwarzają ryzyko, które potencjalnie prowadzić może do kalectwa lub śmierci.
Nie ma dowodów na to, że system transdermalny, plaster, taki jak EVRA, jest bezpieczniejszy niż złożone doustne środki antykoncepcyjne.
Złożone hormonalne środki antykoncepcyjne a nowotwory
Rak szyjki macicy
Nowotwory szyjki macicy również występują częściej u kobiet stosujących złożone hormonalne środki antykoncepcyjne. Jednak może to być spowodowane innymi czynnikami, w tym choroby przenoszone drogą płciową.
Rak piersi
Opisywano częstsze występowanie raka piersi u kobiet przyjmujących złożone hormonalne środki antykoncepcyjne, jednak nie wiadomo czy jest to spowodowane ich stosowaniem.
Wykrywanie większej ilości raków piersi u kobiet stosujących złożone hormonalne środki antykoncepcyjne może być spowodowane częstszymi badaniami kontrolnymi przeprowadzanymi u tych kobiet. Może to oznaczać, że istnieje większa szansa na wykrycie raka piersi.
Zwiększone ryzyko stopniowo zmniejsza się po odstawieniu złożonych hormonalnych leków antykoncepcyjnych. Po dziesięciu latach ryzyko jest takie samo jak u kobiet, które nigdy nie stosowały złożonej hormonalnej antykoncepcji.
Nowotwory wątroby
Donoszono o rzadkich przypadkach łagodnych guzów wątroby, w których nie wykryto komórek rakowych u kobiet stosujących złożone hormonalne środki antykoncepcyjne. Jeszcze rzadziej obserwowano występowanie guzów wątroby, które są nowotworami. Mogą one powodować krwotok wewnętrzny z bardzo silnym bólem brzucha. Jeżeli opisany stan wystąpi, należy natychmiast skontaktować się z lekarzem.
3. Jak stosować lek EVRA
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty.
- W przeciwnym razie może wystąpić zwiększone ryzyko zajścia w ciążę.
- W razie wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Jako zabezpieczenie w razie nieprawidłowego zastosowania plastra należy zawsze dysponować niehormonalnymi środkami antykoncepcyjnymi (takimi jak prezerwatywy, pianka czy gąbka).
Ile plastrów, należy użyć
- Tygodnie 1., 2. i 3.: Należy przykleić i zostawić jeden plaster dokładnie na siedem dni.
- Tydzień 4.: Nie stosuje się żadnego plastra w tym tygodniu.
W razie niestosowania hormonalnej antykoncepcji w poprzednim cyklu
- Można rozpocząć przyjmowanie tego leku w pierwszym dniu kolejnego krwawienia miesiączkowego.
- Gdy upłynął jeden lub więcej dni od momentu pojawienia się krwawienia miesiączkowego należy zapytać lekarza o czasowe zastosowanie niehormonalnej metody antykoncepcji.
Zmiana metody antykoncepcji z doustnej tabletki antykoncepcyjnej na system transdermalny EVRA
W przypadku zmiany metody antykoncepcji z doustnej tabletki antykoncepcyjnej na plaster EVRA:
- należy poczekać do momentu pojawienia się krwawienia miesiączkowego,
- następnie należy przykleić pierwszy plaster w ciągu pierwszych 24 godzin krwawienia miesiączkowego.
Jeżeli plaster zostanie przyklejony po upływie „Dnia 1.” krwawienia miesiączkowego, należy:
- stosować niehormonalną metodę antykoncepcji do „Dnia 8.”, kiedy następuje zmiana plastra.
Jeżeli krwawienie miesiączkowe nie wystąpi w ciągu 5 dni od przyjęcia ostatniej doustnej tabletki antykoncepcyjnej, należy skonsultować się z lekarzem przed rozpoczęciem stosowania leku EVRA.
Zmiana metody antykoncepcji z tabletek zawierających wyłącznie progestagen, wkładki lub zastrzyków na lek EVRA
- Stosowanie leku EVRA można rozpocząć w dowolnym dniu po zaprzestaniu stosowania tabletek zawierających wyłącznie progestagen, w dniu usunięcia wkładki lub w dniu przypadającego kolejnego zastrzyku.
- Należy nakleić plaster pierwszego dnia po zaprzestaniu stosowania tabletek zawierających wyłącznie progestagen, w dniu usunięcia wkładki lub w dniu przypadającego kolejnego zastrzyku.
- Jednocześnie należy stosować niehormonalną metodę antykoncepcji do „Dnia 8.”, kiedy następuje zmiana plastra.
Po przerwaniu ciąży lub poronieniu przed 20 tygodniem ciąży
- Należy porozmawiać z lekarzem prowadzącym.
- Można rozpocząć przyjmowanie leku od razu.
Gdy upłynął jeden lub więcej dni od przerwania ciąży lub poronienia do rozpoczęcia przyjmowania tego leku, należy zapytać lekarza o czasowe zastosowanie niehormonalnej metody antykoncepcji.
Po przerwaniu ciąży lub poronieniu po 20 tygodniu ciąży
- Należy porozmawiać z lekarzem prowadzącym.
Można rozpocząć przyjmowanie leku w Dniu 21. po przerwaniu ciąży lub poronieniu lub w pierwszym dniu okresu, zależnie od tego, co będzie wcześniej.
Po porodzie
- Należy porozmawiać z lekarzem prowadzącym.
- Jeśli kobieta nie karmi piersią, nie należy rozpoczynać stosowania tego leku wcześniej niż 4 tygodnie po porodzie.
- W przypadku, gdyby kobieta zaczęła stosować lek później niż 4 tygodnie po porodzie należy przez pierwsze 7 dni stosowania tego leku stosować dodatkową mechaniczną metodę antykoncepcji.
Gdyby po porodzie doszło do stosunku płciowego, należy przed rozpoczęciem stosowania tego leku poczekać do pierwszego krwawienia miesiączkowego lub zwrócić się do lekarza prowadzącego by wykluczyć ciążę.
Karmienie piersią
- Należy porozmawiać z lekarzem prowadzącym.
- Nie należy stosować tego leku podczas karmienia piersią lub jeśli kobieta planuje karmienie piersią (patrz również punkt 2 Ciąża i karmienie piersią).
Ważne informacje w czasie stosowania plastrów
- Należy zmieniać plaster EVRA zawsze tego samego dnia tygodnia. Wynika to z faktu, że plaster został zaprojektowany tak, aby działać przez 7 dni.
- W żadnym przypadku nie wolno dopuścić, aby przerwa pomiędzy okresami stosowania plastrów wynosiła więcej niż 7 kolejnych dni.
- W tym samym czasie może być stosowany tylko jeden plaster.
- Nie należy przecinać plastra ani naruszać go w jakikolwiek sposób.
- Należy unikać naklejania plastra na obszarach zaczerwienionej, podrażnionej lub uszkodzonej skóry.
- Plaster musi ściśle przylegać do skóry, żeby prawidłowo działał.
- Plaster należy mocno docisnąć, żeby jego krawędzie dobrze przylegały.
- Nie należy używać kremów, olejków, płynnych pudrów, pudrów czy makijażu na skórę w miejscu, gdzie przyklejany jest plaster lub blisko przyklejonego plastra. Może to spowodować odklejenie się plastra.
- Nie należy przyklejać nowego plastra w tym samym miejscu, co poprzedni plaster, gdyż zwiększa to prawdopodobieństwo wystąpienia podrażnienia skóry.
- Należy sprawdzać codziennie, czy plaster nie odpadł.
- Nie należy przerywać stosowania plastrów nawet wtedy, gdy kontakty seksualne są rzadkie.
Jak stosować plastry:
Jeżeli po raz pierwszy stosuje się lek EVRA, należy poczekać do dnia wystąpienia krwawienia miesiączkowego.
Kiedy przykleić pierwszy plaster Evra?
- Pierwszy plaster antykoncepcyjny należy przykleić w ciągu 24 godzin od rozpoczęcia miesiączki.
- Jeżeli plaster został przyklejony po pierwszej dobie miesiączki, należy stosować niehormonalny środek antykoncepcyjny do Dnia 8, kiedy zmienia się plaster.
- Dzień, w którym przykleja się pierwszy plaster stanowi „Dzień 1.”. „Dzień zmiany plastra” musi przypadać zawsze na ten sam dzień każdego tygodnia.
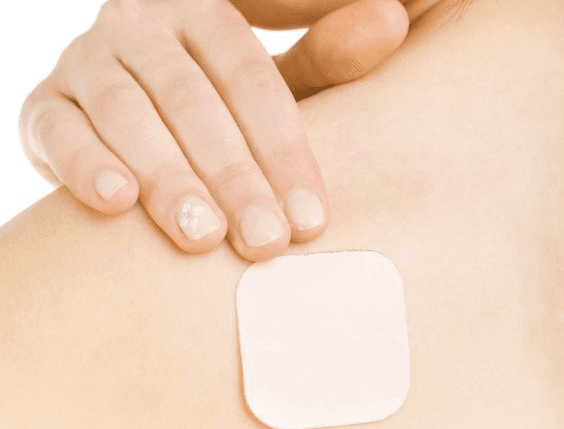
Należy wybrać miejsce na ciele, w którym będzie przyklejony plaster.
- Plaster powinien być zawsze przyklejany na czystą, suchą, nieowłosioną skórę.
- Należy przykleić plaster na skórze pośladków, brzucha, zewnętrznej górnej części ramienia lub górnej części pleców – w miejscach, w których ciasna odzież nie będzie ocierała plastra.
- Plastra nigdy nie wolno umieszczać na piersiach.
Należy otworzyć palcami foliową saszetkę.
- Należy otworzyć rozdzierając wzdłuż brzegu (nie wolno używać nożyczek).
- Należy uchwycić mocno róg plastra i wyjąć go ostrożnie z foliowej saszetki.
- Na powierzchni plastra znajduje się przezroczysta folia ochronna.
- Czasami plastry mogą przyklejać się do wewnętrznej strony saszetki – należy zachować ostrożność, by przypadkowo nie usunąć przezroczystej folii podczas wyjmowania plastra.
- Następnie należy odkleić połowę ochronnej, przezroczystej folii (patrz rysunek).
Należy unikać dotykania powierzchni klejącej.
Plaster należy przyłożyć do skóry.
- Następnie usunąć pozostałą połowę folii ochronnej.
- Mocno przyciskać plaster dłonią przez 10 sekund.
- Należy upewnić się, że brzegi plastra mocno przylegają do skóry.
Plaster należy nosić przez 7 dni (jeden tydzień).
- W pierwszym „Dniu zmiany plastra”, tj. w Dniu 8. należy odkleić zużyty plaster.
- Należy natychmiast przykleić nowy plaster.
- W Dniu 15. (Tydzień 3.) należy odkleić zużyty plaster.
- Należy przykleić kolejny, nowy plaster.
Razem daje to trzy tygodnie z naklejonymi plastrami.
Aby uniknąć podrażnienia skóry, nie należy przyklejać nowego plastra dokładnie na to samo miejsce, w którym przyklejony był poprzedni plaster.
Nie należy nosić plastra w Tygodniu 4. (od Dnia 22. do Dnia 28.).
- W tym okresie powinno wystąpić krwawienie.
- Podczas tego tygodnia kobieta jest zabezpieczona przed zajściem w ciążę tylko w przypadku, gdy w zalecanym czasie przyklei następny plaster.
Następnie należy rozpocząć nowy, czterotygodniowy cykl
- Należy przykleić nowy plaster w normalnie przypadającym „Dniu zmiany plastra”, tj. w następnym dniu po Dniu 28.
- Należy to zrobić niezależnie od momentu, kiedy krwawienie rozpoczyna się lub kończy.
Jeżeli pacjentka chce zmienić „Dzień zmiany plastra” na inny dzień tygodnia, należy porozmawiać z lekarzem prowadzącym.
Należy zakończyć aktualny cykl, zdejmując trzeci plaster we właściwym dniu. W Tygodniu 4. można wybrać nowy „Dzień zmiany plastra”, naklejając pierwszy plaster następnego cyklu w wybranym dniu. W żadnym wypadku przerwa pomiędzy stosowaniem plastrów nie może przekraczać 7 kolejnych dni.
W celu przesunięcia krwawienia miesiączkowego należy nakleić następny plaster na początku Tygodnia 4. (w Dniu 22.) zamiast przerwy w Tygodniu 4. Może wystąpić niewielkie krwawienie.
Nie należy stosować więcej niż 6 plastrów (czyli nie dłużej niż 6 tygodni) z rzędu. Po zastosowaniu 6 plastrów (przez kolejne 6 tygodni) nie przyklejać plastra w Tygodniu 7. Po 7 dniach przykleić plaster przyjmując ten dzień jako Dzień 1 rozpoczętego nowego cyklu. Należy skontaktować się z lekarzem prowadzącym przed decyzją o przesunięciu krwawienia miesiączkowego.
Codzienne czynności podczas stosowania plastrów
- Normalne czynności, takie jak kąpiel lub prysznic, korzystanie z sauny czy ćwiczenia fizyczne, nie powinny wpływać na skuteczność działania plastra.
- Plaster został tak zaprojektowany, by pozostawał na swoim miejscu podczas tego rodzaju aktywności.
- Jednakże zaleca się sprawdzenie, czy plaster nie odkleił się po wykonaniu wymienionych wyżej czynności.
Jeżeli zachodzi potrzeba umieszczenia plastra w innym miejscu w dniu innym niż „Dzień zmiany plastra”
Jeżeli plaster powoduje podrażnienie skóry lub występuje dyskomfort przy jego noszeniu.
- Można go odkleić i zastąpić nowym plastrem w innym miejscu ciała do czasu kolejnego „Dnia zmiany plastra”.
- Jednocześnie można stosować tylko jeden plaster.
Jeżeli występują trudności z pamiętaniem, by zmieniać plaster
- Należy porozmawiać z lekarzem, farmaceutą lub pielęgniarką o tym, jak ułatwić zmianę plastra oraz o ewentualnej potrzebie zastosowania innej metody antykoncepcji.
Jeżeli plaster zaczyna luźno przylegać, jego brzegi odstają lub odklejają się
Przez okres krótszy od jednego dnia (do 24 godzin).
- Należy postarać się przykleić plaster ponownie lub natychmiast przykleić nowy plaster.
- Nie jest konieczna inna zabezpieczająca metoda antykoncepcji.
- „Dzień zmiany plastra” powinien pozostać bez zmian.
- Nie należy starać się ponownie przyklejać plaster, jeżeli:
+ nie jest już wystarczająco klejący,
+ skleił się lub przykleił do innej powierzchni,
+ przykleił się do niego inny materiał,
+ po raz drugi luźno przylegał lub odkleił się.
- Nie należy używać taśm klejących lub opasek, by utrzymać plaster na miejscu.
- Jeśli nie udaje się ponownie przykleić plastra, należy natychmiast przykleić nowy.
Przez okres dłuższy niż jeden dzień (24 godziny lub dłużej) lub jeżeli nie ma pewności, ile czasu upłynęło.
- Należy natychmiast rozpocząć nowy czterotygodniowy cykl poprzez przyklejenie nowego plastra.
- W tym momencie następuje nowy „Dzień 1.” oraz nowy „Dzień zmiany plastra”.
- Przez pierwszy tydzień nowego cyklu należy stosować niehormonalną metodę antykoncepcji.
W przypadku nieprzestrzegania powyższych zasad możliwe jest zajście w ciążę.
Jeżeli nastąpi pominięcie zmiany plastra
Na początku każdego cyklu (Tydzień pierwszy (Dzień 1.):
Jeżeli nastąpi pominięcie przyklejenia plastra, istnieje szczególnie wysokie ryzyko zajścia w ciążę.
- Istnieje konieczność stosowania niehormonalnej metody antykoncepcji jako dodatkowego zabezpieczenia przez jeden tydzień.
- Należy przykleić pierwszy plaster nowego cyklu zaraz po uświadomieniu sobie pominięcia.
- W tym momencie następuje nowy „Dzień zmiany plastra” oraz nowy „Dzień 1.”
W środku cyklu (Tydzień 2. lub 3.):
Jeżeli nastąpi pominięcie zmiany plastra w ciągu jednego do dwóch dni (do 48 godzin).
- Należy przykleić nowy plaster zaraz po uświadomieniu sobie pominięcia
- Nowy plaster należy przykleić w normalnie przypadającym „Dniu zmiany plastra”.
Nie jest konieczna dodatkowa zabezpieczająca metoda antykoncepcji.
Przez więcej niż 2 dni (48 godzin lub więcej)
- Jeżeli nastąpi pominięcie zmiany plastra w czasie dłuższym niż 2 dni (48 godzin lub dłużej) istnieje ryzyko zajścia w ciążę.
- Należy rozpocząć nowy czterotygodniowy cykl zaraz po uświadomieniu sobie pominięcia, przyklejając nowy plaster.
- W tym momencie następuje nowy „Dzień zmiany plastra” i nowy „Dzień 1.”.
- Przez pierwszy tydzień nowego cyklu istnieje konieczność stosowania dodatkowej zabezpieczającej metody antykoncepcji.
Przy końcu cyklu (Tydzień 4.):
Jeżeli nie usunie się plastra we właściwym czasie.
- Należy odkleić go zaraz po uświadomieniu sobie tego faktu.
- Następny cykl należy rozpocząć w normalnie przypadającym „Dniu zmiany plastra”, tj. w dniu po Dniu 28.
Nie ma konieczności stosowania dodatkowej zabezpieczającej metody antykoncepcji.
W przypadku braku bądź nieregularnych krwawień podczas stosowania leku
Podczas stosowania tego leku w tygodniach z naklejonym plastrem mogą wystąpić nieoczekiwane krwawienia z pochwy lub plamienia
- Objawy te zwykle ustępują po kilku pierwszych cyklach.
- Plamienia i niewielkie krwawienia mogą być również spowodowane błędami w stosowaniu plastrów.
- Nie należy przerywać stosowania tego leku, a jeśli krwawienie utrzymuje się dłużej niż przez pierwsze trzy cykle, należy skontaktować się z lekarzem lub farmaceutą.
Jeśli w tygodniu bez naklejonego plastra (Tydzień 4.) nie wystąpi krwawienie z odstawienia, należy mimo wszystko przykleić nowy plaster w normalnie przypadającym „Dniu zmiany plastra”.
- Jeśli ten lek był stosowany właściwie, a krwawienie nie występuje, nie oznacza to koniecznie zajścia w ciążę.
- Jednakże jeśli nie wystąpią dwa kolejne krwawienia, należy skonsultować się z lekarzem lub farmaceutą, gdyż może to oznaczać zajście w ciążę.
W przypadku przyklejenia (w jednym czasie) więcej niż jednego plastra
Konieczne jest usunięcie plastrów i natychmiastowy kontakt z lekarzem.
Zastosowanie zbyt wielu plastrów może spowodować wystąpienie poniższych objawów:
- nudności i wymioty,
- krwawienie z pochwy.
Przerwanie stosowania leku
Mogą wystąpić nieregularne lub skąpe krwawienia miesięczne lub ich brak. Dzieje się tak zwykle w ciągu pierwszych 3 miesięcy, szczególnie w przypadkach, kiedy przed stosowaniem leku krwawienia miesiączkowe były nieregularne.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
4. Możliwe działania niepożądane
Jak każdy lek, ten lekmoże powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Jeśli wystąpią jakiekolwiek działania niepożądane, szczególnie ciężkie i nieprzemijające lub zmiany w stanie zdrowia, które pacjent uważa za związane ze stosowaniem leku, należy skonsultować się z lekarzem.
Dla wszystkich kobiet stosujących złożone hormonalne środki antykoncepcyjne istnieje zwiększone ryzyko powstania zakrzepów krwi w żyłach (żylna choroba zakrzepowo-zatorowa) lub zakrzepów krwi w tętnicach (zaburzenia zakrzepowo-zatorowe tętnic). W celu uzyskania szczegółowych informacji dotyczących różnych czynników ryzyka związanych ze stosowaniem złożonych hormonalnych środków antykoncepcyjnych, należy zapoznać się z punktem 2 „Informacje ważne przed zastosowaniem (leku) EVRA”.
Bardzo częste działania niepożądane (mogą wystąpić u więcej niż 1 na 10 kobiet):
- ból głowy,
- nudności,
- tkliwość piersi.
Częste działania niepożądane (mogą wystąpić u mniej niż 1 na 10 kobiet):
- zakażenia drożdżakowe pochwy, niekiedy zwane pleśniawkami,
- zaburzenia nastroju takie jak depresja, zmiany nastroju lub huśtawki nastroju, lęk, płaczliwość,
- migrena,
- ból brzucha lub wzdęcie,
- wymioty lub biegunka,
- trądzik, wysypka, świąd skóry lub podrażnienie skóry,
- skurcze mięśni,
- zaburzenia ze strony piersi takie jak ból, powiększenie lub guzki w piersiach,
- zmiany cyklu miesięcznego, skurcze macicy, bolesne krwawienia, upławy z pochwy,
- reakcje skórne w miejscu przyklejenia plastra (takie jak zaczerwienienie, podrażnienie, świąd lub wysypka),
- uczucie zmęczenia lub złe samopoczucie,
- zwiększenie masy ciała.
Niezbyt częste objawy niepożądane (mogą wystąpić u mniej niż 1 na 100 kobiet):
- reakcja alergiczna, pokrzywka,
- obrzęki spowodowane zatrzymaniem wody w organizmie,
- zwiększone stężenie lipidów we krwi (takich jak cholesterol czy trójglicerydy),
- zaburzenia snu (bezsenność),
- zmniejszenie libido,
- wyprysk, zaczerwienienie skóry,
- nieprawidłowe wytwarzanie mleka,
- zespół napięcia przedmiesiączkowego,
- suchość pochwy,
- inne reakcje skórne w miejscu przyklejenia plastra,
- obrzęki,
- wysokie ciśnienie tętnicze lub wzrost ciśnienia tętniczego,
- zwiększony apetyt,
- wypadanie włosów,
- nadwrażliwość na światło słoneczne.
Rzadkie działania niepożądane (mogą wystąpić u mniej niż 1 na 1000 kobiet):
- szkodliwe zakrzepy krwi w żyle lub tętnicy, na przykład:
+ w nodze lub stopie (zakrzepica żył głębokich),
+ w płucach (zatorowość płucna),
+ zawał serca,
+ udar,
+ miniudar lub przejściowe objawy udaru, znane jako przemijający napad niedokrwienny,
+ zakrzepy krwi w wątrobie, żołądku/jelicie, nerkach lub oku.
Prawdopodobieństwo powstania zakrzepów krwi może być wyższe, jeśli u pacjentki występują jakiekolwiek inne czynniki zwiększające to ryzyko (patrz punkt 2 w celu uzyskania dalszych informacji dotyczących czynników zwiększających ryzyko powstania zakrzepów krwi i objawów wystąpienia zakrzepów krwi).
- rak piersi, szyjki macicy lub wątroby,
- problemy w miejscu przyklejenia plastra takie jak wysypka, pęcherze lub owrzodzenia,
- łagodne nienowotworowe guzki w piersiach lub w wątrobie,
- włókniaki macicy,
- gniew lub uczucie frustracji,
- zwiększone libido,
- zaburzenia smaku,
- problemy w przypadku stosowania soczewek kontaktowych,
- nagłe ostre zwiększenie ciśnienia tętniczego krwi (przełom nadciśnieniowy),
- zapalenie pęcherzyka żółciowego lub jelita grubego,
- nieprawidłowy wymaz z szyjki macicy,
- brązowe plamki lub plamy na skórze twarzy,
- kamienie żółciowe lub zablokowanie przewodu żółciowego,
- zażółcenie skóry i oczu,
- nieprawidłowe stężenie glukozy lub insuliny we krwi,
- obrzęk twarzy, ust, gardła lub języka,
- wysypka na skórze z tkliwymi czerwonymi guzkami na udach lub podudziach,
- świąd skóry,
- łuskowata, łuszcząca się, swędząca i zaczerwieniona skóra,
- zahamowanie laktacji,
- upławy z pochwy,
- zastój płynów w kończynach dolnych,
- zastój płynów,
- obrzęk ramion, dłoni, nóg lub stóp.
W przypadku wystąpienia rozstroju żołądka
- Wymioty lub biegunka nie powinny mieć wpływu na ilość hormonów wchłoniętych z leku
- W przypadku rozstroju żołądka nie ma potrzeby stosowania dodatkowych środków antykoncepcyjnych.
W czasie pierwszych 3 cykli możliwe są plamienia, delikatne krwawienie, tkliwość piersi lub nudności. Objawy te powinny zazwyczaj ustąpić, ale jeśli tak się nie stanie należy porozmawiać z lekarzem lub farmaceutą.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane w tym wszelkie możliwe objawy niepożądane niewymienione w ulotce, należy zwrócić się do lekarza lub farmaceuty.
Działania niepożądane można zgłaszać bezpośrednio do „krajowego systemu zgłaszania” wymienionego w załączniku V. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
5. Jak przechowywać lek
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na saszetce i pudełku.
Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią.
Nie przechowywać w lodówce ani nie zamrażać.
Zużyte plastry nadal zawierają pewną ilość aktywnych hormonów. Należy zachować szczególną ostrożność przy usuwaniu plastrów, aby chronić środowisko. Aby pozbyć się zużytych plastrów, należy:
- od zewnętrznej strony saszetki odkleić etykietę służącą usuwaniu plastrów,
- zużyty plaster położyć na etykiecie tak, aby lepka powierzchnia pokrywała zacieniowaną powierzchnię,
- na przyklejony zużyty plaster ponownie nakleić etykietę i wyrzucić w miejscu niedostępnym dla dzieci.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek
Substancjami czynnymi leku są: norelgestromin i etynyloestradiol. Każdy system transdermalny, plaster o powierzchni 20 cm2 zawiera 6 mg norelgestrominu i 600 mikrogramów etynyloestradiolu.
Substancje czynne są uwalniane przez 7 dni ze średnią prędkością 203 mikrogramów norelgestrominu oraz 34 mikrogramów etynyloestradiolu w ciągu 24 godzin.
Pozostałe składniki (substancje pomocnicze) to: warstwa tylna: warstwa zewnętrzna – polietylen z dodatkiem barwnika, o małej gęstości, warstwa wewnętrzna – poliester; warstwa środkowa: klej poliizobutylenowo-polibutenowy, krospowidon, nietkany materiał z poliestru, mleczan laurylowy; warstwa trzecia: powłoka z tereftalanu polietylenu (PET) pokryta polidimetylosiloksanem.
Jak wygląda lek i co zawiera opakowanie
EVRA jest cienkim systemem transdermalnym, plastrem z tworzywa sztucznego, koloru beżowego z napisem ”EVRA”. Po zdjęciu przezroczystej warstwy ochronnej z tworzywa sztucznego, plaster przykleja się stroną pokrytą klejem na skórę.
Lek ten jest dostępny w następujących opakowaniach: pudełka zawierające 3, 9 albo 18 systemów transdermalnych w oddzielnych, pokrytych folią saszetkach, owinięte po trzy sztuki w przezroczystą, perforowaną folię.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny:
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgia
Wytwórca:
Janssen Pharmaceutica NV
Turnhoutseweg 30
B-2340 Beerse
Belgia
Nie znalazłeś tego czego szukasz? Sprawdź
Nie tego leku szukasz? Sprawdź pozostałe lekarstwa